はじめに
2020年10月30日の2020年第3四半期決算以降、特に目立ったニュースの無かったアルトリア・グループ(MO)だが(12月2日に2020年通期の調整後希薄化1株当たり利益が4.30~4.38ドルであることをアルトリア自体が再確認してはいる。市場予想は4.37ドル)、昨日掲題の発表をしている。フィリップ・モリス(PM)も同種の発表をしているので、アルトリアの発表をベースにその内容について整理しておく。
FDAによるIQOS3の承認
アルトリア・グループの発表内容
以下はアルトリア・グループの企業ページより引用・抜粋。
- Altria Group, Inc. (Altria) (NYSE: MO) announces today that the U.S. Food and Drug Administration (FDA) authorized commercialization of the next generation of the IQOS tobacco heating system device, IQOS 3, in the U.S.
アルトリア・グループは本日、米国食品医薬品局(FDA)が次世代のIQOSタバコ加熱システムデバイスであるIQOS3の米国での商品化を承認したことを発表しました - FDA authorization follows review of the IQOS 3 Premarket Tobacco Product Application (PMTA) submitted by Philip Morris International Inc. (PMI).
FDAの承認は、Philip Morris International Inc.(PMI)によって提出されたIQOS 3市販前タバコ製品申請書(PMTA)のレビューに基づいています - Philip Morris USA (PM USA), under an exclusive agreement with PMI, commercializes the IQOS system in the U.S. with three HeatStick variants.
フィリップ・モリスUSA*(PM USA)は、PMIとの独占契約に基づき、3種類のIQOSシステムを備えたHeatStickを米国で商品化しています - IQOS 3 offers several enhancements to the IQOS 2.4 currently being sold in select U.S. markets, including a longer battery life, faster re-charging time, a side opening mechanism, and magnetic closure.
IQOS 3はより長いバッテリー寿命、より速い再充電時間、側面開放メカニズム、磁気閉鎖など、現在米国の一部の市場で販売されているIQOS2.4にいくつかの拡張機能を提供します - IQOS is currently available in the Atlanta, Georgia, Richmond, Virginia and Charlotte, North Carolina markets. With PMTA authorization of IQOS 3, PM USA expects to begin quickly marketing the IQOS 3 device to U.S. adult smokers once the regulatory and U.S. importation logistics have been satisfied.
IQOSは現在、ジョージア州アトランタ、バージニア州リッチモンド、ノースカロライナ州シャーロットの市場で販売されています。IQOS3のPMTA承認によりPM USAは、規制及び米国の輸入ロジスティクスが満たされた暁には、IQOS3デバイスを米国の成人喫煙者に迅速に販売し始めるものと期待しています
Editors Note(編集者注):
- On March 30, 2020, PMI submitted a supplemental PMTA to the FDA for the IQOS 3 tobacco heating system device. The original IQOS 2.4 device was authorized by the FDA for commercialization in the U.S. on April 30, 2019.
2020年3月30日、PMIはIQOS3たばこ加熱システム装置の補足PMTAをFDAに提出しました。オリジナルのIQOS2.4デバイスは、2019年4月30日に米国での商品化がFDAによって承認されました - On July 7, 2020 the FDA authorized the marketing of the IQOS 2.4 tobacco heating system as a modified risk tobacco product with a reduced exposure claim.
2020年7月7日、FDAは、IQOS 2.4たばこ加熱システムを、曝露が低減された修正リスクタバコ製品として販売することを承認しました - IQOS 2.4 is the first next-generation inhalable tobacco product to be authorized as a modified risk tobacco product.
IQOS 2.4は、修正リスクタバコ製品として認可された最初の次世代吸入たばこ製品です - The IQOS 3 PMTA authorization is independent of the MRTP authorization for the IQOS 2.4 device. PMI expects to file a MRTP application with the FDA for IQOS 3 seeking authorization of a reduced exposure claim*.
IQOS 3 PMTAの許可は、IQOS2.4デバイスのMRTP承認とは独立しています。 PMIは、暴露低減請求の承認を求めるIQOS3のMRTP申請をFDAに提出する予定です
以下自分の注意書き:
*ややこしいのだが、フィリップ・モリスUSAはアルトリア・グループ(MO)の運営会社。フィリップ・モリス(PM)の運営会社ではない
*暴露低減については2020年7月にまとめた以下の記事を参照
FDAがIQOSを曝露低減タバコ製品とし販売許可(2020/7)
フィリップ・モリスの発表内容
以下はフィリップ・モリスの企業ページより引用・抜粋。アルトリアと内容的に重複しない部分のみ。
- In its decision the FDA noted that:International survey data reviewed by the agency found no evidence of increased uptake of IQOS by youth or young adults, while use patterns available for a previously authorized version of IQOS within the U.S. have not raised new concerns regarding product use in youth and young adults.
その決定において、FDAは次のように述べています。
当局によってレビューされた国際調査データは、青年または若年成人によるIQOSの取り込み増加の証拠を発見しませんでした、また米国内で以前に承認されたバージョンのIQOSで利用可能な使用パターンは、青年および若年成人での製品使用に関する新たな懸念を引き起こしていません
まとめ
要するに簡単にまとめてしまうと
- FDAがIQOS3の米国内での販売を承認
- IQOS2.4からバッテリー寿命や充電時間などの点でアップデート
- ただ現行のIQOS2.4は暴露低減タバコ製品として認可されているが、IQOS3はまだ
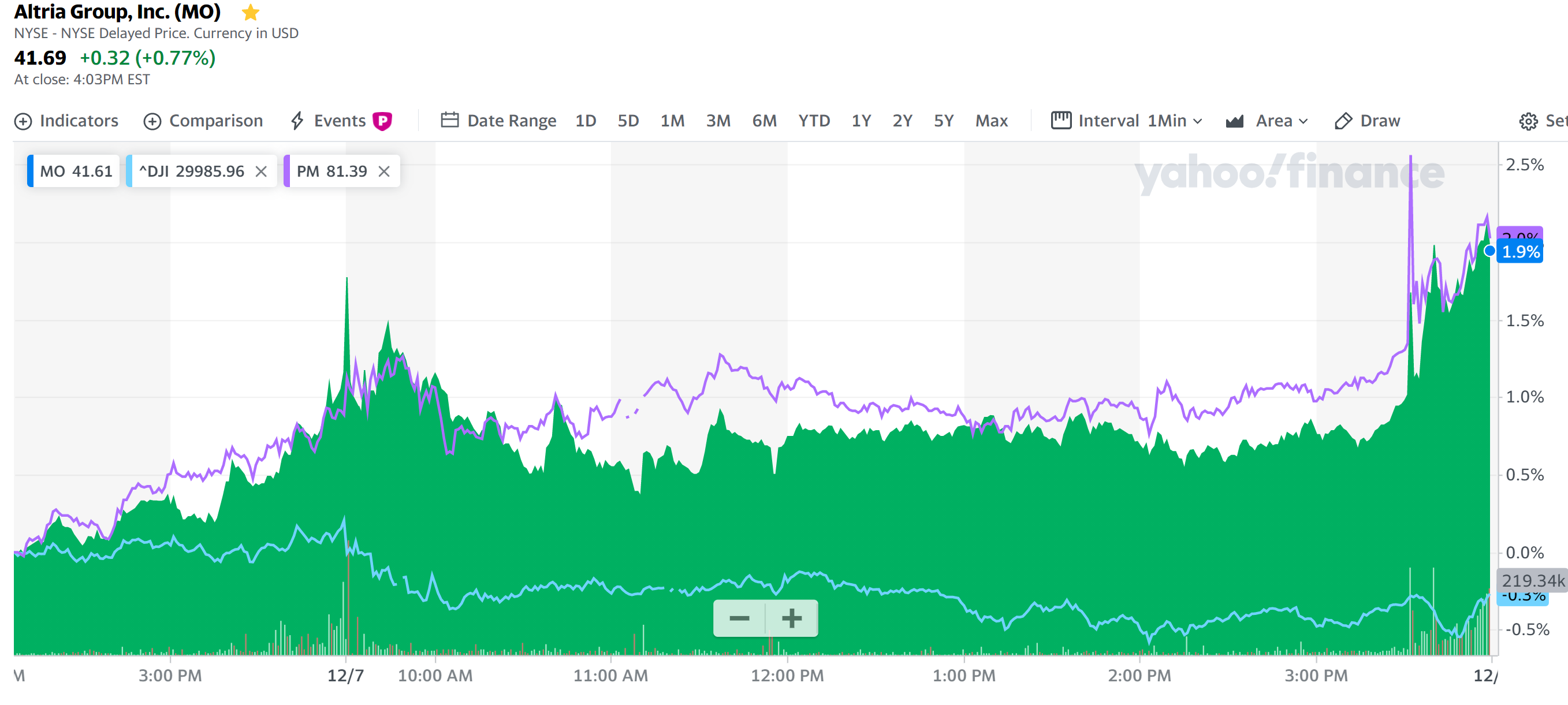
という内容で済んでしまう気がする。個人的には特に目新しい内容でもないと思っている。何故わざわざまとめておいたかというと、昨日のアルトリアとフィリップ・モリスの株価がこの発表後に如実に変動したため。
発表があったのはアルトリアが現地時間の15時半ぐらい。元々ダウ工業平均(水色)に比べるとMOもPMも上回っていたが、この発表以降に一段増となっている(フィリップ・モリスの発表は米国市場閉場後)。この株価の変動具合を見ると、市場では今回の発表はそれなりに評価された模様。
自分が思った以上に影響があったのは何故だろう。やはり長い目でみれば既存のタバコ製品から、IQOSの様な代替タバコ製品への移行という大きな流れを考えると、こういった小さい(と自分には思われる)プロセスを経ていくことが、特に米国ではFDAがかなり厳しいスタンスでタバコ製品に臨んでいるので。タバコ企業にとっては重要なのかもしれない。